2017/05/03
細胞膜を越えてタンパク質を輸送するモータータンパク質の詳細な作動原理を解明
~新たな抗生物質の開発に期待~
【概要】
- 細胞膜を越えてタンパク質を輸送するモーター分子「SecDF」の立体構造を高い解像度で決定
- 膜透過するタンパク質と相互作用する部位や、水素イオンの通り道を解明
- 膜を越えたタンパク質輸送機構の構造基盤は、新規抗生物質開発にも有用
すべての生物は細胞膜によって外界と隔離された細胞システムを持っています。また、細胞膜を通して細胞内で合成されたタンパク質を細胞外に輸送することも、生命の維持にとって不可欠な現象です。バクテリア(細菌)では、細胞膜に存在する分子モータータンパク質「SecDF」という輸送役のタンパク質が、水素イオンの濃度の変化による濃度勾配から得られるエネルギーを利用して、合成したタンパク質を細胞外へと牽引すると考えられています。しかし、膜透過するタンパク質に働きかける部位や水素イオンの通り道など、SecDFの詳細は不明のままでした。
奈良先端科学技術大学院大学(学長:横矢直和)バイオサイエンス研究科の塚崎智也准教授らの研究グループは、SecDFの立体構造をこれまでにない高い分解能(2.6-2.8Å分解能)で決定することに成功しました。
この構造情報を基に理研、大阪大学、京都大学の研究者らと協力し,生化学的な実験やコンピュータを用いて分子の挙動を推測する分子動力学計算を進めました。その結果、膜透過するタンパク質とSecDFの結合部位を同定、水素イオンが通過しうる細胞膜内の道を見出しました。
さらなる解析によって、水素イオンの濃度勾配を利用してSecDFの全ドメインがダイナミックな構造変化をおこすことが考えられました。SecDFが駆動するタンパク質の膜透過の新しい分子メカニズムを提唱しました。
本研究は、膜を超えたタンパク質の輸送メカニズムという生命に必須の現象を解明し生命科学の発展に寄与するとともに、バクテリアに特有のタンパク質であるSecDFを標的とした新規抗生物質の開発の構造基盤となります。
この成果は、米国東部時間の平成29年5月2日(火)付のCell Reports誌(Cell Press社)のオンライン版12 p.m.に掲載されます【プレス解禁日時:日本時間平成29年5月3日(水)午前1時00分】。
【掲載論文】
論文タイトル :Tunnel Formation Inferred from the I-Form Structures of the Proton-Driven Protein Secretion Motor SecDF
書誌情報 : Arata Furukawa, Kunihito Yoshikaie, Takaharu Mori, Hiroyuki Mori, Yusuke V Morimoto, Yasunori Sugano, Shigehiro Iwaki, Tohru Minamino, Yuji Sugita, Yoshiki Tanaka, Tomoya Tsukazaki; Cell Reports, Volume 19, Issue 5, 2 May 2017, Pages 895-901
DOI : https://doi.org/10.1016/j.celrep.2017.04.030
naistar:http://hdl.handle.net/10061/11714(NAIST Academic Repository:naistar)
【解説】
(1)研究背景
すべての細胞は、細胞膜によって外界と隔てられています。生命を維持するためには、細胞膜を介した適切な物質の輸送が必要です。生命にとって重要な物質の種々のタンパク質は、細胞質でリボソームによって合成されます。このタンパク質の約30%は、細胞膜を越えて外界へと輸送され機能します。これらのタンパク質は、すべての生物に保存された「Secトランスロコン(バクテリアではSecYEG複合体)*3」というトンネルを通って細胞外へと輸送されます(図1)。Secトランスロコンは受動的なトンネルであり、タンパク質の輸送には他のタンパク質を必要とします。バクテリアでは、2つのモータータンパク質SecAとSecDFが、この過程を駆動します。SecDFはバクテリアに特有の膜タンパク質で膜貫通ドメイン(領域)と細胞外ドメインからなります。SecDFは膜貫通ドメインを介した水素イオンの細胞内への流入に伴い、「F型」、「I型」といわれる2つの構造を繰り返しとることにより、SecYEGから出てきたタンパク質を捕まえ細胞外へと牽引するとされています。しかし、これまでに報告されているSecDFの全長構造はF型のみであり、さらなる詳細な議論を行うために高い解像度でのI型の情報が必要でした。
(2)研究内容
今回、本研究グループは、細菌Deinococcus radiodurans由来のSecDFのI型の結晶構造を高い分解能(2.6-2.8 Å分解能、1オングストロームは100億分の1㍍)で決定することに成功しました。SecDFを測定試料とするための結晶化は、脂質キュービック相(LCP)法*4という方法で行い、大型放射光施設SPring-8*5 BL32XU(ビームライン)においてX線回折データを収集しました。
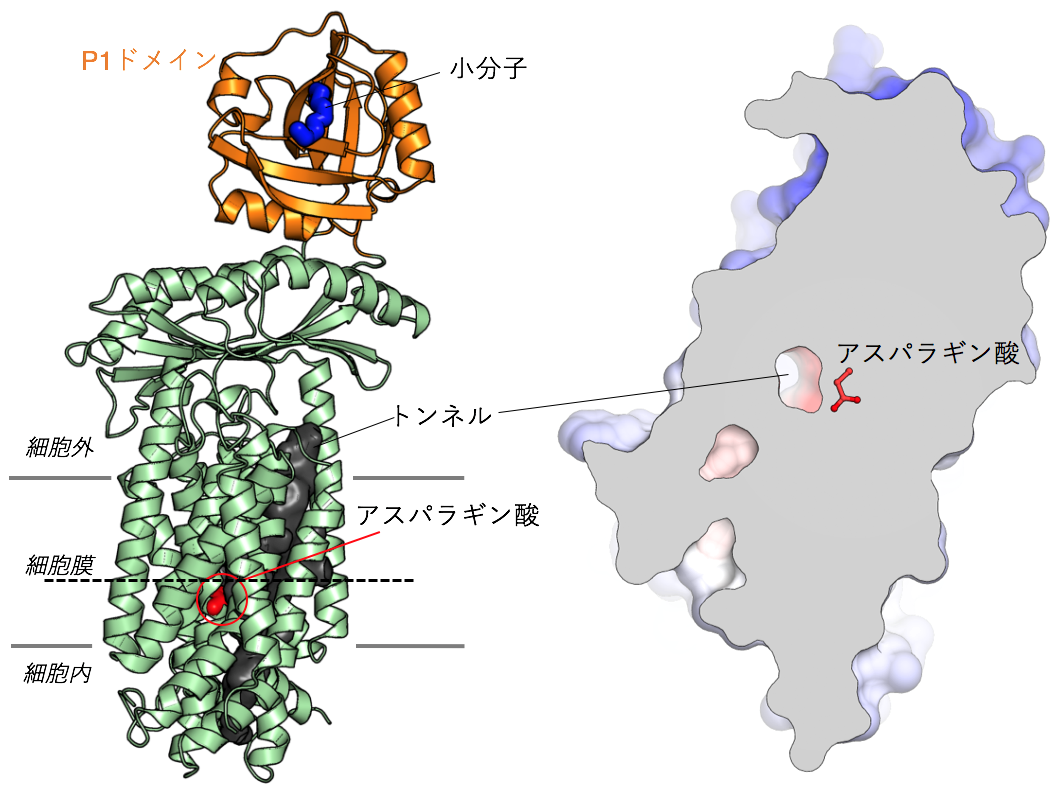
今回決定したSecDFのI型構造には、2つの特筆すべき特徴がみられました(図2)。1つめの特徴として、SecDFの細胞外ドメインの1つである「P1ドメイン」のくぼみにタンパク質の一部を模した小分子が結合していたことです。そこで、細胞外へと輸送されるタンパク質とSecDFの相互作用部位を生化学的な実験により確認したところ、このくぼみで特異的な相互作用が認められました。これらの結果から、このくぼみが輸送タンパク質の結合部位であることが予測されます。
2つめの特徴として、SecDFの膜貫通領域ドメインに細胞内側から細胞外側まで貫通したトンネル構造が認められたことです。このトンネルの中心には、SecDFの機能(水素イオン透過とタンパク質輸送活性)に必須のアスパラギン酸が存在していたため、この領域が水素イオンの通り道であることが推測されます。コンピュータを用いたSecDFの分子動力学計算*6を行ったところ、このアスパラギン酸の水素イオンの結合状態の変化によりトンネルの開閉が起こること、トンネル内に水分子が入り込み水素結合を介して細胞質から細胞外まで一列に並ぶことが観察されました。こうしたことから、このトンネルを通って水素イオンが細胞外から細胞質へと流入すること考えられます。また、P1ドメインは可動性に富む領域ですが、この領域を固定したSecDFは水素イオンの流入とタンパク質の膜透過活性が阻害されたため、P1ドメインの動きと水素イオンとの関連性が示されました。
これら結果と過去の知見を組み合わせることで、「SecDFはF型の状態でP1ドメインのくぼみで輸送タンパク質と結合し、I型へと移行することで輸送タンパク質を細胞外へと牽引する。この構造変化は、膜貫通ドメインに形成されるトンネルに入り込んだ水分子を介した水素イオンの流入に伴い生じるエネルギーにより駆動される。このサイクルを繰り返すことによりタンパク質の輸送が達成される」という新規モデルを提唱しました(図3)。


【研究の位置づけ】
本研究では、生体内に存在する極小のモーターであるSecDFの作動メカニズムを明らかにしました。タンパク質の膜を越えた輸送という生命に不可欠な現象に関わるSecDFのメカニズムの解明は、当該分野の基礎研究に大きく貢献します。また、SecDFはバクテリアに特有かつ重要なタンパク質であることから、SecDFを標的とした新たな抗生物質の開発のための構造基盤として利用されることも期待されます。
本研究成果は、科学技術振興機構(JST)戦略的創造研究推進事業(さきがけ)「Secタンパク質膜透過装置の次世代構造生物学」(JPMJPR12L3)、科研費(JP15J08235, JP15H01537, JP16K14713, JP26291023, JP26119007)などの支援を受けました。
【用語説明】
※1 SecDF:タンパク質の細胞外への膜透過を促進するバクテリアに特有の膜タンパク質。創薬標的としても注目されている。
※2 分解能:対象物をどの程度まで識別できるかという能力。本稿での高い分解能とは、その値(単位はÅ)がより低いものをさし、それだけ細部まで識別可能。
※3 Secトランスロコン:タンパク質が膜を越えるための透過孔を形成する膜タンパク質複合体。すべての生物に保存されており、バクテリアではSecY、SecE、SecGからなる複合体(SecYEG)で、真核生物ではSec61αγβ。
※4 脂質キュービック相(LCP)法:タンパク質を脂質二重層に再構成させた状態で結晶化させる手法。近年、膜タンパク質の結晶化法の一つとしてスタンダード。
※5 SPring-8:兵庫県佐用町に位置する世界最大級の大型放射光施設。強いX線を用いた実験が可能。
※6 分子動力学計算:分子動力学(Molecular Dynamics)を用いて、タンパク質などの生体分子の挙動を計算する研究手法。
【本研究内容についてコメント出来る方】
東京大学 大学院理学系研究科 生物科学専攻
教授 濡木 理 (ぬれき おさむ)
E-mail:[email protected] TEL:03-5841-4392, 03-5841-4394(秘書)
【本プレスリリースに関するお問い合わせ先】
奈良先端科学技術大学院大学 バイオサイエンス研究科 膜分子複合機能学研究室
准教授 塚崎 智也
E-mail:[email protected] TEL:0743-72-5551






